NOVA IORQUE — InkDesign News — Um estudo liderado pela Weill Cornell Medicine revela um caminho inédito para conter a metástase do câncer de mama triplo negativo (TNBC), destacando a enzima EZH2 como peça central na proliferação e disseminação tumoral. Os resultados, publicados em 2 de outubro na revista Cancer Discovery, sugerem que fármacos que inibem a atuação dessa enzima podem restaurar a ordem na divisão celular e limitar o avanço do TNBC.
O Contexto da Pesquisa
O câncer de mama triplo negativo é reconhecido por sua agressividade e resistência a terapias convencionais, especialmente devido à alta taxa de metástase. Esse subtipo representa desafios significativos, já que cerca de 5% das células do tumor primário apresentam alta probabilidade de migrar para outros órgãos. Essas células metastáticas geralmente se caracterizam por instabilidade cromossômica e alterações epigenéticas — modificações que não alteram o DNA, mas impactam sua expressão.
Dr. Vivek Mittal, professor e membro do Sandra and Edward Meyer Cancer Center na Weill Cornell Medicine, destaca o significado central do estudo:
“Metastasis is the main reason patients with triple negative breast cancer face poor survival odds,” (“A metástase é a principal razão pela qual pacientes com câncer de mama triplo negativo enfrentam prognóstico reservado de sobrevivência.”)
— Vivek Mittal, Ford-Isom Research Professor, Weill Cornell Medicine
As terapias convencionais frequentemente tentam exacerbar a instabilidade cromossômica, apostando em levar as células tumorais ao colapso. O novo estudo, porém, desafia essa ideia, propondo restabelecer a ordem na divisão celular como estratégia mais eficaz.
Resultados e Metodologia
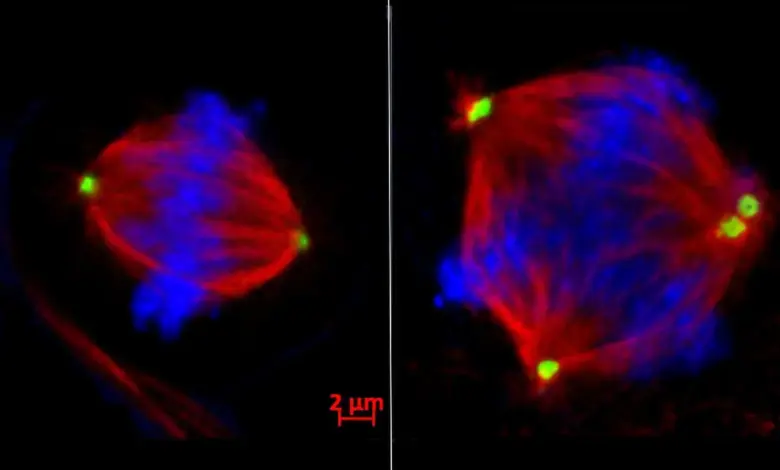
A investigação identificou que a proteína EZH2, quando superexpressa, silencia genes essenciais para a adequada segregação cromossômica durante a mitose, intensificando os erros de divisão celular e a instabilidade cromossômica. Análise de dados clínicos mostrou que pacientes com níveis elevados de EZH2 apresentam mais alterações nos cromossomos tumorais.
Utilizando o fármaco tazemetostat, já aprovado para outros tipos de câncer, a equipe conseguiu reduzir essa instabilidade em linhas celulares, enquanto a elevação artificial de EZH2 amplificava os erros. Modelos murinos com alta expressão de EZH2 também apresentaram mais metástases pulmonares.
O grupo elucidou o mecanismo molecular: EZH2 silencia o gene da tankirase 1, levando ao acúmulo da proteína CPAP e à multiplicação descontrolada de centrosomos, culminando em divisões celulares anômalas. Inibir a enzima restaurou o equilíbrio mitótico, reduzindo a propagação do tumor.
“For the first time, we have linked EZH2, which is an epigenetic regulator, with chromosomal instability in a mechanistic fashion.” (“Pela primeira vez, conectamos a EZH2, reguladora epigenética, à instabilidade cromossômica de forma mecanística.”)
— Shelley Yang Bai, pós-doutoranda, Weill Cornell Medicine
Implicações e Próximos Passos
Segundo os pesquisadores, inibidores de EZH2 podem inaugurar uma nova classe de terapias aptas a agir na raiz da instabilidade cromossômica, reprimindo, assim, a metástase. A oncologista Magdalena Plasilova ressalta o impacto da descoberta para pacientes:
“This study provides a promising new approach to treating triple-negative breast cancer by targeting the root cause of metastases.” (“Este estudo oferece uma nova abordagem promissora para tratar o câncer de mama triplo negativo, ao atacar a causa raiz das metástases.”)
— Magdalena Plasilova, professora associada, Weill Cornell Medical Center
A equipe planeja iniciar testes clínicos de segurança com o tazemetostat e avaliar outros potenciais inibidores de EZH2, tanto para o TNBC quanto para outros cânceres com instabilidade cromossômica, como o adenocarcinoma pulmonar.
O avanço sugere uma nova direção para terapias oncológicas de alta precisão, e especialistas preveem que, além da possível readequação de medicamentos já existentes, o entendimento dos processos epigenéticos poderá informar o desenvolvimento de futuras intervenções personalizadas no combate à metástase, um dos principais desafios do câncer contemporâneo.
Fonte: (ScienceDaily – Ciência)