Barcelona — InkDesign News — Pesquisadores do Centro de Regulação Genômica (CRG), em Barcelona, identificaram um mecanismo inédito de defesa em células cancerígenas comprimidas, detalhado em estudo na Nature Communications. O fenômeno revela uma resposta energética instantânea que auxilia a sobrevivência celular em ambientes físicos adversos.
O Contexto da Pesquisa
Células cancerígenas frequentemente enfrentam pressões mecânicas ao migrar pelo microambiente tumoral, infiltrar vasos sanguíneos ou suportar o próprio fluxo sanguíneo. Entender como sobrevivem a essas forças é essencial para o desenvolvimento de estratégias antimetastáticas. Pesquisas anteriores já haviam revelado o papel das mitocôndrias como centrais energéticas, mas o novo estudo sugere uma função dinâmica diante de desafios mecânicos extremos.
Resultados e Metodologia
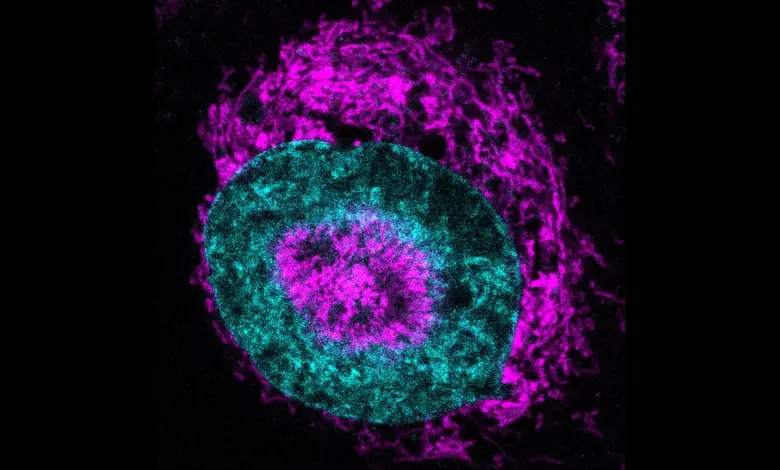
Utilizando um microscópio especializado capaz de comprimir células vivas a apenas três micrômetros de largura, os cientistas observaram que, segundos após a compressão, as mitocôndrias das células HeLa migraram rapidamente para a superfície do núcleo, resultando em uma injeção de ATP — a principal molécula energética celular. Esse evento, chamado de NAMs (nucleus-associated mitochondria), ocorreu em 84% das células comprimidas contra quase nenhum registro em células livres de pressão.
Em experimentos adicionais, sensores fluorescentes detectaram um aumento de cerca de 60% de ATP nuclear em apenas três segundos após o estímulo mecânico. Esse suprimento energético foi decisivo: permitiu que as células reparassem rapidamente quebras no DNA, frequentes sob estresse mecânico. Sem essa energia extra, as células apresentaram falhas na divisão.
“It forces us to rethink the role of mitochondria in the human body. They aren’t these static batteries powering our cells, but more like agile first responders that can be summoned in emergency situations when cells are literally pressed to the limit.”
(“Isso nos força a repensar o papel das mitocôndrias no corpo humano. Elas não são apenas baterias estáticas que energizam as células, mas atuam como ágeis socorristas, convocadas em situações de emergência quando as células são literalmente levadas ao extremo.”)— Dr. Sara Sdelci, coautora correspondente, Centro de Regulação Genômica
O envolvimento do citoesqueleto, especialmente de filamentos de actina e da rede do retículo endoplasmático, foi essencial para segurar as mitocôndrias na formação do halo. Interromper a montagem dessa estrutura, usando latrunculina A, resultou no desaparecimento das NAMs e da onda energética associada.
“It’s a clear sign the cells are adapting to the strain and rewiring their metabolism.”
(“É um sinal claro de que as células estão se adaptando ao estresse e reconfigurando seu metabolismo.”)— Dr. Fabio Pezzano, co-primeiro autor, Centro de Regulação Genômica
A relevância clínica foi verificada em 17 biópsias de tumores de mama: halos de NAMs apareceram em 5,4% dos núcleos em áreas invasivas, contra 1,8% no núcleo tumoral denso.
Implicações e Próximos Passos
A identificação do mecanismo NAM sugere alvos terapêuticos inovadores para conter a capacidade invasiva de tumores, bloqueando a formação do arcabouço que permite a resposta energética sem afetar mitocôndrias de tecidos saudáveis. Os pesquisadores destacam que essa adaptação pode não se restringir ao câncer, podendo ser fundamental em células do sistema imunológico, neurônios e células embrionárias sob pressão mecânica.
“Wherever cells are under pressure, a nuclear energy boost is likely safeguarding the integrity of the genome.”
(“Sempre que as células estão sob pressão, um impulso energético nuclear provavelmente está protegendo a integridade do genoma.”)— Dr. Sara Sdelci, coautora correspondente, Centro de Regulação Genômica
A descoberta abre caminho para pesquisas sobre novos medicamentos e para avanços na compreensão de doenças ligadas ao estresse mecânico celular. Próximos estudos devem investigar se inibidores do andaime de actina conseguem realmente reduzir a invasividade tumoral em modelos animais e humanos, além de buscar evidências do mesmo mecanismo em outros tipos celulares, indicando uma nova camada de regulação na biologia celular.
Fonte: (ScienceDaily – Ciência)